|
|
|
|
|

|
Das war weniger Ironie und es wird wohl beim Wünschen bleiben mit dem rumpimmeln. 
Vorlesungsfreie Zeit heisst nämlich: länger Praktikum \o/
Praktikumsfreie Zeit heisst: mehr Zeit zum auf Klausuren lernen \o/
Philosophie studieren eignet sich angeblich deutlichst besser zum rumpimmeln.
|
|
|
|
|
|
|
|
|
|
|
Wo gibts denn bitte Praktikumsfreie Zeit? the fuck 
|
|
|
|
|
|
|
|
|

|
| | Zitat von dblmg
Die 4 Stunden pro Tag alleine wären ja nicht scheiße, aber wenn man von 8 bis 14 uhr erstmal Seminare + Vorlesungen hat und dann nochmal 4 Stunden Labor und man erst um 18 uhr aus der Uni raus ist, dann wünscht man sich manchmal doch irgendwie auch mal rumpimmeln zu können, so wie alle anderen studenten :<
| |
Dann hat man ja noch gar nichts gelernt oder Protokolle geschrieben. Und so wie ich die Pharmazeutinnen bei uns in der Bib sehe, gibt es da auch einiges zu lernen.
Ich hab übrigens diese Woche meine Schlenk-Line kaputt gemacht und brauchte kurzfristig Ersatz:

|
|
|
|
|
|
|
|
|
|
|
|
Funfact : wir müssen keine Protokolle mehr schreiben huehuehue
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
So jetzt mal eine Frage an die Pros hier.
Derzeit schrieb ich meine Bachelorarbeit im Maschinenbau/ Kunststofftechnik.
Thema Haftklebstoffe.
Zwar gehen gängige Theorien von einem Aufbau der Klebefestigkeit aufgrund von rheologischen Eigenschaften aus, neue Theorien nehmen jedoch auch ein Aufbau von zwischenmolekularen Bindungen an.
So jetzt die Frage:
Ist es plausibel, wenn diese Bindungen sich erst bei erhöhter Temperatur ausbilden, bzw diese sich bei erhöhter Temperatur vermehrt ausbilden?
Fügepartner ist ein das Polymerblend PC+ABS.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | Zitat von dblmg
Ich studier Pharmazie. Da gibts nicht sowas wie ne Abschlussarbeit. Und da ich ersti bin ist die Promotion auch noch was hin 
Und war 12 Stunden 6 Tage die Woche ernst gemeint? Oder sollte das Ironie sein? 
Die 4 Stunden pro Tag alleine wären ja nicht scheiße, aber wenn man von 8 bis 14 uhr erstmal Seminare + Vorlesungen hat und dann nochmal 4 Stunden Labor und man erst um 18 uhr aus der Uni raus ist, dann wünscht man sich manchmal doch irgendwie auch mal rumpimmeln zu können, so wie alle anderen studenten :<
| |
Als Nebenfächler oder Lehramtsstudent sind die Praktika ja noch human. Wir hatten in der Vorlesungsfreien Zeit ("Semesterferien" wäre blanker Hohn  ) ganztägig Praktikum. Alles außer Bachelor-Chemiker hat nur kürzere/einfachere Praktika gemacht. ) ganztägig Praktikum. Alles außer Bachelor-Chemiker hat nur kürzere/einfachere Praktika gemacht.
Zeit zum rumpimmeln oder lernen hat man, wenn man sich reinhängt und dann einfach 1-2 Wochen früher fertig ist. 
War beim Quali sehr schön: Während die Fällung gefiltert oder getrocknet wird, kann man schon ne Titration nebenbei machen. Einfach mal am Anfang sich nen Plan machen, was alles so parallel funktioniert und dann durchziehen.
|
|
[Dieser Beitrag wurde 1 mal editiert; zum letzten Mal von kepper* am 08.06.2013 20:13]
|
|
|
|
|
|
|
|
|
Hattet ihr dann auch während der Vorlesungszeit Praktikum?
Und Lehramtler, ha. 4 Stunden in der Woche Praktikum...
|
|
|
|
|
|
|
|
|
|
|
| | Zitat von Atani
Wenn die Bindungsknüpfung über einen Übergangszustand verläuft, dann kann das schon plausibel sein.
Von Polymeren habe ich quasi keine Ahnung, daher kann ich dir speziell dazu nicht wirklich was sagen.
| |
Haftklebstoffe liegen im Prinzip als hochviskose Flüssigkeiten vor und liefern ihre Haftkraft durch genau diese Eigenschaft. Nach dem Aufbringen härten sie nicht aus sondern bleiben weiterhin hochviskos. Obs da ein Übergangszustand gibt...keine Ahnung 
Bis ins kleinste Detail sind die Adhäsionstheorien für Haftklebstoffe noch nicht ausgereift 
Aber wenn das plausibel sein kann, nehm ich das einfach mal so an 
|
|
|
|
|
|
|
|
|
|
|
So, wiedermal eine Analysefrage:
Ich hab in meiner Analyse scheinbar Chlorid, Sulfat, Carbonat, Kobalt und Aluminium.
Ich schwanke nun zwischen Zink und Mangan.
Ich bekomme natürlich mit Natronlauge einen NS, aber das kann ja genauso vom Al oder Kobalt kommen. Andererseits habe ich heute auf der Oxidationssschmelze auch kein Mangan gesehen.
Gibt es da irgendwelche guten, spezifischen Nachweise die so nicht im Werner stehen? 
|
|
|
|
|
|
|
|
|

|
|
Boraxperle! Boraxperle! Boraxperle!
|
|
|
|
|
|
|
|
|
|
|
bei mir war bei Mangan + OH der NS mit so kleinen braunen Körnern (so ähnlich wie beim Al-NS)
Hast du Al mit Thenards Blau nachgewiesen?
Und wie Hast du Zink nachgewiesn?
e: du machst natürlich immer schön den KGT, oder? 
|
|
[Dieser Beitrag wurde 1 mal editiert; zum letzten Mal von Flash_ am 17.06.2013 22:25]
|
|
|
|
|
|
|
|
|
Öh, ich hab die analyse schonmal angegeben mit den oben genannten inklusive Kupfer. Kam dann mit +1|-1 zurück. Hab nochmal auf kupfer getestet und das war es nun doch nicht 
Achja, was mich gewundert hat, dass es mit Kaliumhexacyanoferrat(II) einen ziemlich hellblauen NS gab, der aber nicht zu turnbulls/berlinerblau passt.
Ich kann mir partou nicht erklären woher das kommt. Wahrscheinlich aber, bildet sich irgendein Cobaltsalz, die ja sowieso so gut wie immer blau sind...?
¤: Du meinst KTG? Wer macht denn noch sowas? 
|
|
[Dieser Beitrag wurde 1 mal editiert; zum letzten Mal von dblmg am 17.06.2013 22:32]
|
|
|
|
|
|
|
|
|
Wir hatten gar kein Kobalt, wahrscheinlich aus pädagogischen Gründen 
Sah der NS ungefähr so aus? 

das wäre 2 AlCl3 + CoCl2 + 4 H2O -> CoAl2O4 + 8 HCl
|
|
|
|
|
|
|
|
|
|
|
| | Zitat von dblmg
¤: Du meinst KTG? Wer macht denn noch sowas? 
| |
Bei uns war es so, immer wenn wir die Assis was Fragen wollten war die erste Gegenfrage: "Hast du den Trennungsgang gemacht?". Wenn irgendwas nicht funktionierte "Hast du den Trennungsgang gemacht?" 
|
|
[Dieser Beitrag wurde 3 mal editiert; zum letzten Mal von Flash_ am 17.06.2013 22:52]
|
|
|
|
|
|
|
|
|
Aber Kobalt gibt so eine wunderschöne Boraxperle :>
Und ich hab denNS nicht zentrifugiert. Aber wieso sollte das Spinell erst auftreten, wenn ich Hexacyanoferrat(II) dazugebe?
|
|
|
|
|
|
|
|
|
|
|
|
Habs mit dem FeIII-Nachweis mit Thiocyanat verwechselt. Dort stört ja Cobalt bei hoher SCN-Konzentration, weil es einen blassblauen Komplex bildet.
|
|
|
|
|
|
|
|
|
|
|
| | Zitat von Cola-SixPack
| | Zitat von dblmg
Die 4 Stunden pro Tag alleine wären ja nicht scheiße, aber wenn man von 8 bis 14 uhr erstmal Seminare + Vorlesungen hat und dann nochmal 4 Stunden Labor und man erst um 18 uhr aus der Uni raus ist, dann wünscht man sich manchmal doch irgendwie auch mal rumpimmeln zu können, so wie alle anderen studenten :<
| |
Dann hat man ja noch gar nichts gelernt oder Protokolle geschrieben. Und so wie ich die Pharmazeutinnen bei uns in der Bib sehe, gibt es da auch einiges zu lernen.
Ich hab übrigens diese Woche meine Schlenk-Line kaputt gemacht und brauchte kurzfristig Ersatz:
https://dl.dropboxusercontent.com/u/5878871/2013-06-05%2016.32.13.jpg
| |
Alter, das ist ja die oberscheiße. 
Aber sehr kreativ.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
Schemes sind IMMER Reaktionsschemas, also Dinge mit Pfeil.
Ohne Beleg, schau Dich einfach mal in dem Journal Deiner Wahl um und machs genauso. Den Wiley-Stil zum Beispiel find ich deutlich lesbarer was solche und ähnliche fragen angeht als der ACS-Scheiss 
|
|
|
|
|
|
|
|
|

|
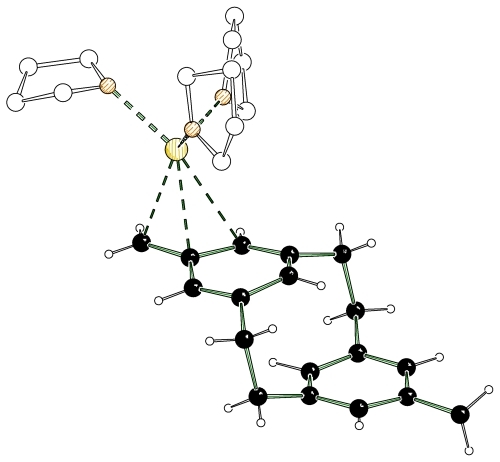
Wahrscheinlich meine letzte Kristallstruktur. :-/ Beende im September mein Postdoc-Dasein an der Uni...
|
|
[Dieser Beitrag wurde 1 mal editiert; zum letzten Mal von TemplaR_AGEnt am 11.09.2013 10:37]
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
Ja... Corporate Design sozusagen.
|
|
|
|
|
|
|
|
|
|
|
|
Gibt es Regel, welches Alkalimetall das stärkste Reduktionsmittel ist? Bisher bin ich davon ausgegangen, dass die Reduktionskraft mit der Elektropositivität nach unten hin steigt. Jetzt lese ich aber gerade, dass KCl mit Natrium zu K und NaCl reagiert. Ich kann mir das theoretisch mit der Hydradationsenthalpie erklären, sehe aber keine Struktur darin...
|
|
|
|
|
|
|
|
|
|
|
Was du suchst müsste die elektrochemische Spannungsreihe sein
Das IMPP hat die Auswertung für das erste Staatsexamen der Pharmazeuten rausgeben.
2.schlechtestes Uniergebnis im Bereich organische Chemie  ,aber bei der Vorlesung und dem Labor dazu muss man sich da nicht wundern ,aber bei der Vorlesung und dem Labor dazu muss man sich da nicht wundern 
Instrumentelle Analyse sogar schlechteste Uni.
|
|
[Dieser Beitrag wurde 1 mal editiert; zum letzten Mal von Gasbrand am 16.09.2013 18:18]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
| | Zitat von kepper*
Gibt es Regel, welches Alkalimetall das stärkste Reduktionsmittel ist? Bisher bin ich davon ausgegangen, dass die Reduktionskraft mit der Elektropositivität nach unten hin steigt. Jetzt lese ich aber gerade, dass KCl mit Natrium zu K und NaCl reagiert. Ich kann mir das theoretisch mit der Hydradationsenthalpie erklären, sehe aber keine Struktur darin...
| |
Vorsicht, Hydratationsenthalpie impliziert ja eine Reaktion in wässriger Lösung und da treten ja sicherlich keine elementaren Alkalimetalle auf. Passiert das ganze in Schmelze? Oder in irgendeinem aprotischen Lösungsmittel?
Ich nehme an, dass die höhere Gitterenergie von Natriumchlorid (780 kJ/mol) dafür verantwortlich ist, dass die Reaktion sich umdreht, die man eigentlich gemäß der elektrochemischen Spannungsreihe erwarten würde. Ich finde grade keine Zahlen zur Gitterenergie von KCl, um das zu untermauern.
|
|
|
|
|
|
|
|
|
|
|
Ist hier zufällig einer der Zugriff auf Chemistry Letters hat?
Eine PM wäre sehr gern gesehen.
|
|
|
|
|
|
|
|
| Thema: Chemie ( Similia similibus solvuntur. ) |